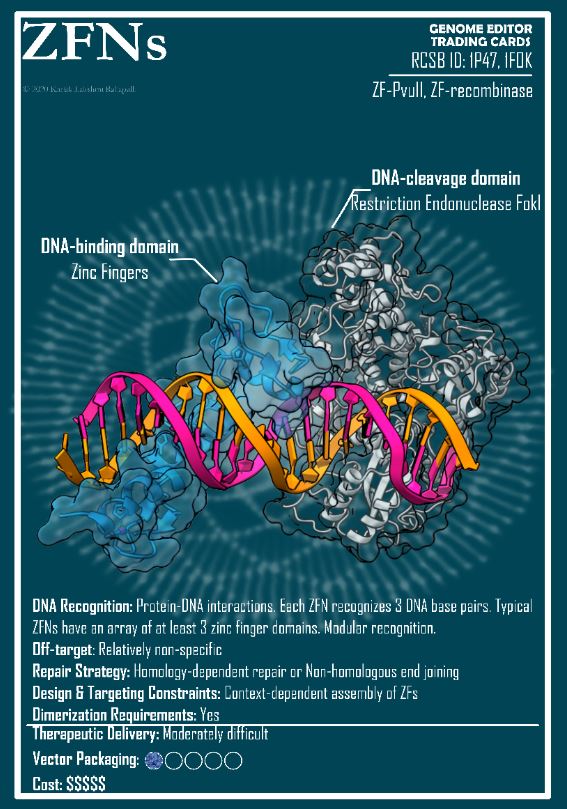
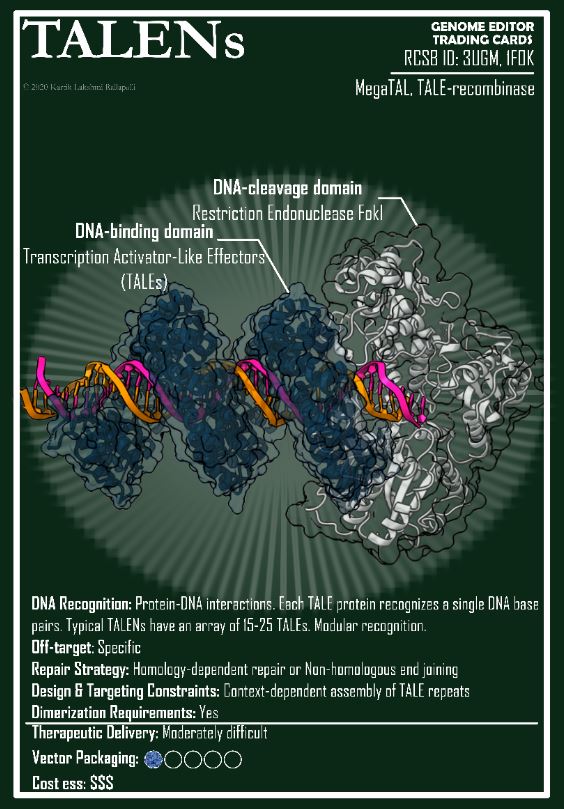
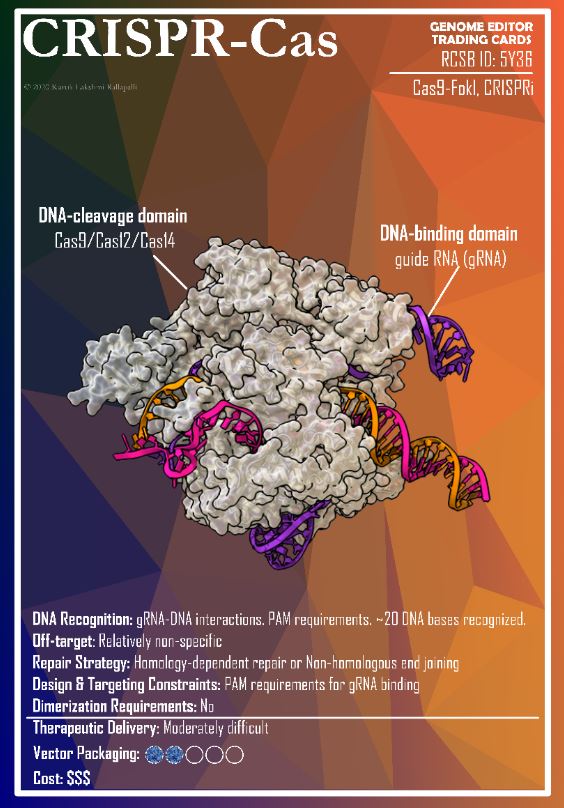
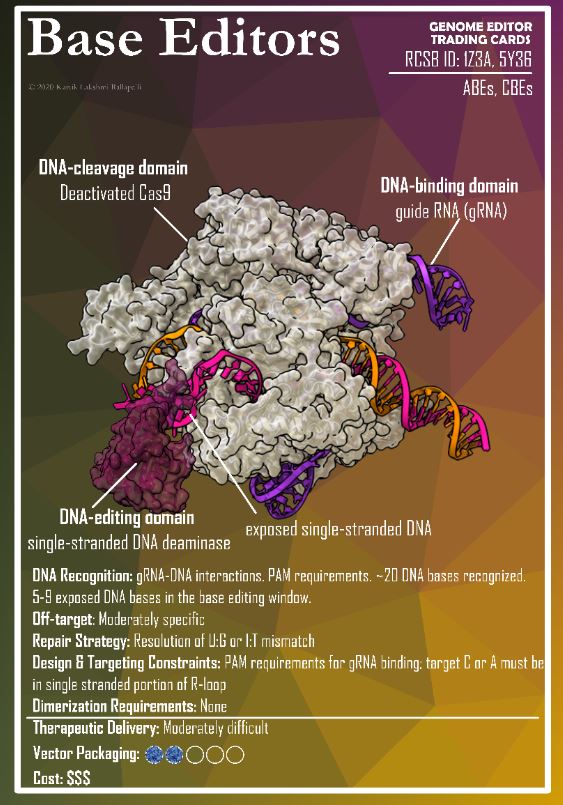
David Liu, l’inventore dei modelli avanzati di CRISPR, ha ricevuto il Breakthrough Prize dalle mani di Jodie Foster e Lily Collins (Emily in Paris), ma la più applaudita è stata la giovane paziente Alyssa Tapley (qui in mezzo alle due star). Lo show per l’assegnazione del premio (più ricco e glamorous dei Nobel) è andato in scena il 12 aprile a Santa Monica, davanti a una folta platea di stelle del cinema e della tecnofinanza. Un modello di comunicazione-spettacolo che non sembra replicabile in Europa, ma merita di essere approfondito (ne ho scritto per Osservatorio Terapie Avanzate) e visto (qui la serata completa, qui la parte dedicata all’editing).