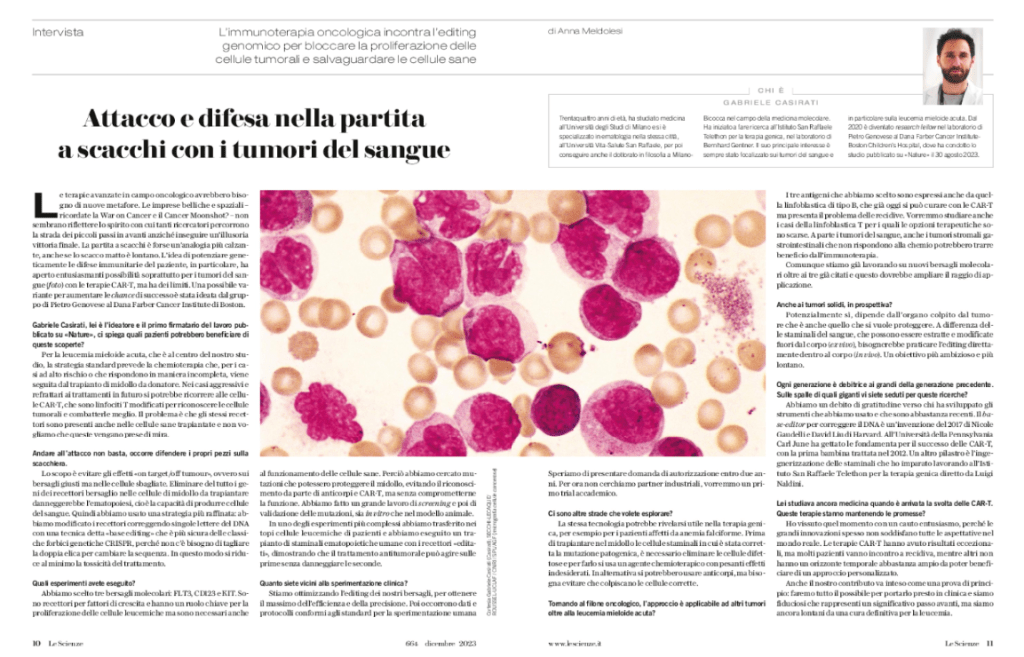
Chi si interessa alle terapie avanzate in campo oncologico conosce bene la sigla CAR-T. Si tratta di linfociti T modificati (anche con l’aiuto di CRISPR) per riconoscere e attaccare meglio le cellule tumorali, e si sono già rivelati una strategia vincente per i tumori del sangue. La novità è che si sta facendo strada la convinzione che un approccio simile possa dimostrarsi utile anche per la sclerosi multipla, che è una malattia autoimmune. L’idea consiste nell’usare le CAR-T per impedire ai linfociti B dei malati di attaccare le cellule nervose, anche nel cervello. La prima sperimentazione clinica è ai nastri di partenza negli Usa, per saperne di più c’è questa news di Nature.
Veniamo alle TEA, o Nuove Tecniche Genomiche per usare l’espressione dei documenti ufficiali europei sulle nuove biotecnologie agrarie. La proposta di regolamentazione della Commissione europea (approvata dal Parlamento UE il 7 febbraio) esclude l’utilizzo di piante editate o cisgeniche nell’agricoltura organica, ma tra i produttori del biologico iniziano a farsi avanti le prime voci aperturiste, che fanno sperare in una possibile convivenza pacifica tra i diversi tipi di coltivazioni negli anni a venire.
Per finire segnaliamo l’ultimo avanzamento in campo zootecnico: i maiali resistenti ai virus porcini ottenuti grazie all’editing genetico. Il paper è uscito sul CRISPR Journal, ma potete leggerne anche su GEN.