 Molti di noi sono in vacanza, ma CRISPR no. Due segnalazioni dunque sono d’obbligo: il gruppo di George Church ha annunciato su Science di aver messo al mondo 15 maialini ripuliti con l’editing genomico dai retrovirus, di cui uno ha già raggiunto i 4 mesi di età. E’ stato rimosso, insomma, uno degli ostacoli sulla via degli xenotrapianti. Questi animali ora potranno essere utilizzati per ulteriori modificazioni, che rendano i loro organi compatibili con il sistema immunitario umano per evitare il rigetto. Secondo il genetista di Harvard la tecnologia sarà pronta per il debutto in questo campo nel giro di soli due anni. Un altro articolo della stessa rivista misura la temperatura dell’opinione pubblica americana sull’editing di geni umani, concludendo che i giudizi sono diversificati e la sfida più urgente è trovare il modo migliore per coinvolgere le persone nel processo decisionale che porterà alla regolamentazione della tecnologia.
Molti di noi sono in vacanza, ma CRISPR no. Due segnalazioni dunque sono d’obbligo: il gruppo di George Church ha annunciato su Science di aver messo al mondo 15 maialini ripuliti con l’editing genomico dai retrovirus, di cui uno ha già raggiunto i 4 mesi di età. E’ stato rimosso, insomma, uno degli ostacoli sulla via degli xenotrapianti. Questi animali ora potranno essere utilizzati per ulteriori modificazioni, che rendano i loro organi compatibili con il sistema immunitario umano per evitare il rigetto. Secondo il genetista di Harvard la tecnologia sarà pronta per il debutto in questo campo nel giro di soli due anni. Un altro articolo della stessa rivista misura la temperatura dell’opinione pubblica americana sull’editing di geni umani, concludendo che i giudizi sono diversificati e la sfida più urgente è trovare il modo migliore per coinvolgere le persone nel processo decisionale che porterà alla regolamentazione della tecnologia.
Embrioni umani editati. Perché sì e perché no.
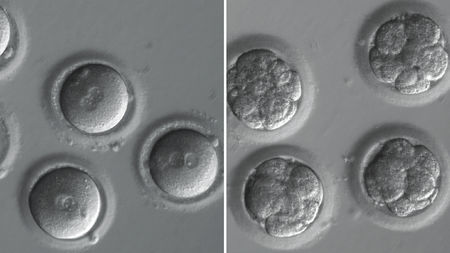
L’exploit annunciato ieri da Nature segna un miglioramento delle performance di CRISPR sugli embrioni umani abbastanza consistente da poter dire che sì, un giorno l’editing della linea germinale probabilmente diventerà un’opzione praticabile. Insomma si potranno correggere alcune malattie genetiche (almeno quelle causate da una singola mutazione) non solo nel singolo individuo modificato ma anche nella sua progenie, in un colpo solo. Anche se è bene dire chiaramente che l’idea che si potranno cancellare le malattie genetiche dalla faccia della Terra è destinata a restare una fantasia, come ha ben spiegato Eric Lander al Summit di Washington del 2015 e come racconto nel mio libro. In breve per le patologie con una base genetica semplice si può trovare quasi sempre un’altra soluzione senza ricorrere all’editing della linea germinale (la diagnosi genetica preimpianto), mentre per le malattie complesse il gioco appare troppo complicato. Ciò detto i risultati raggiunti da Shoukhrat Mitalipov e colleghi sono entusiasmanti in termini di efficienza e precisione: la scienza di CRISPR cammina con gambe sempre più solide e veloci. Quanto alla bioetica dell’esperimento, è il caso di sgombrare il campo dalle formule abusate. Non si tratta di eugenetica (parola che secondo lo storico della scienza Francesco Cassata andrebbe abbandonata perché così compromessa dal punto di vista ideologico da risultare inutile in un dibattito onesto e costruttivo). Non c’entra nulla Hitler, anche se fa tenerezza pensare che la co-inventrice di CRISPR Jennifer Doudna lo sogni nei suoi incubi, come racconta nel suo libro. Lasciamo stare anche l’argomento del pendio scivoloso, che ci farebbe scivolare verso cose già sentite. Mettiamo in campo i fatti, che Science ci ha fatto la cortesia di mettere bene in fila. Continua a leggere
Missione antiterrorismo: l’altra vita di CRISPR
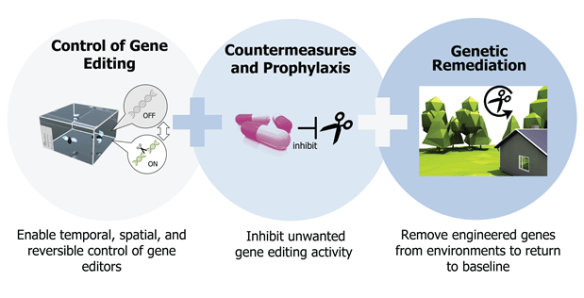
Si chiama “Safe genes”, ovvero geni sicuri, ed è il nuovo programma di ricerca sulle biotecnologie di ultima generazione finanziato dal Dipartimento della difesa degli Stati Uniti, attraverso l’agenzia Darpa, specializzata in tecnologie emergenti. Lo stanziamento, pari a 65 milioni di dollari nell’arco di quattro anni, verrà spartito fra sette gruppi che comprendono i massimi specialisti nel campo della correzione dei genomi: dalla co-inventrice di CRISPR Jennifer Doudna, in forze all’Università di Berkeley, al visionario genetista di Harvard George Church. Le ricerche finanziate sono rilevanti per la sicurezza nazionale perché mirano a evitare che gli strumenti per l’editing genomico, cadendo nelle mani sbagliate, possano trasformarsi in una bio-minaccia. Ma il programma del Darpa è stato pensato anche per favorire lo sviluppo di applicazioni pacifiche, stimolando l’innovazione e contribuendo a risolvere i problemi di biosicurezza che potrebbero insorgere per qualche errore commesso in buona fede nei laboratori civili. Tra gli obiettivi dichiarati, infatti, rientra lo sviluppo di varianti di CRISPR sempre più precise e affidabili, e l’invenzione di sistemi di sicurezza che aiutino a controllare i “gene drive”, ovvero quegli acceleratori della diffusione di geni che sono una delle applicazioni potenzialmente più rivoluzionarie della tecnologia. Continua a leggere
Gli inventori di CRISPR cercano un accordo. Ma Berkeley sta a guardare

Berkeley contro Boston. Jennifer Doudna contro Feng Zhang. Finora la battaglia brevettuale sulla tecnica che sta rivoluzionando le scienze della vita ce l’eravamo raffigurata così. Come un duello tra il gruppo che per primo ha dimostrato la capacità del sistema CRISPR di modificare il genoma delle cellule batteriche e il gruppo che, pochi mesi dopo, l’ha adattato alle cellule degli organismi pluricellulari. Ma il panorama dei brevetti relativi a quella che è stata definita l’invenzione biotech del secolo è più complicato di così. E c’è chi teme che il potenziale rivoluzionario di questa tecnologia di modificazione genetica di precisione possa restare schiacciato sotto una montagna di rivendicazioni di diritti di proprietà intellettuale. La buona notizia è che alcuni degli inventori di CRISPR hanno deciso di far confluire i propri brevetti in un unico pool globale, in modo da non costringere i ricercatori che vogliono usare la tecnica a trattare con decine di soggetti diversi. Ma basterà questo stratagemma per salvaguardare l’interesse comune, che è quello di consentire al maggior numero possibile di gruppi di lavorare con CRISPR trasformando le sue promesse in avanzamenti concreti? Continua a leggere
Un’intelligence per le proteine guerriere. Così funziona CRISPR in natura.
 L’ultimo numero di Science apre uno scorcio inaspettato su CRISPR, il sistema immunitario batterico che ha ispirato l’omonima tecnica di modificazione genetica. A firmare il lavoro è il gruppo di Jennifer Doudna, la biochimica di Berkeley che nel 2012 ha gettato le basi per lo sviluppo della rivoluzionaria tecnologia, subito adottata in tutto il mondo per correggere il DNA di piante, animali e cellule umane. Il nuovo contributo del DoudnaLab per ora rappresenta soprattutto un’affascinante tappa del viaggio nella ricerca di base, ma c’è da scommettere che man mano che i ricercatori sistemeranno gli elementi del puzzle, comprendendo nei dettagli come CRISPR funziona in natura, la ricerca applicata escogiterà nuovi trucchi per arricchire ulteriormente la cassetta degli attrezzi delle nuove biotecnologie di precisione. Continua a leggere
L’ultimo numero di Science apre uno scorcio inaspettato su CRISPR, il sistema immunitario batterico che ha ispirato l’omonima tecnica di modificazione genetica. A firmare il lavoro è il gruppo di Jennifer Doudna, la biochimica di Berkeley che nel 2012 ha gettato le basi per lo sviluppo della rivoluzionaria tecnologia, subito adottata in tutto il mondo per correggere il DNA di piante, animali e cellule umane. Il nuovo contributo del DoudnaLab per ora rappresenta soprattutto un’affascinante tappa del viaggio nella ricerca di base, ma c’è da scommettere che man mano che i ricercatori sistemeranno gli elementi del puzzle, comprendendo nei dettagli come CRISPR funziona in natura, la ricerca applicata escogiterà nuovi trucchi per arricchire ulteriormente la cassetta degli attrezzi delle nuove biotecnologie di precisione. Continua a leggere
CRISPR galoppa. E la scienza diventa arte.
Qualche artista interessato a servirsi di CRISPR per esplorare il confine tra biologia e arte c’è già, ma la verità è che finora sono stati degli scienziati a sviluppare le potenzialità artistiche della genetica nel modo più raffinato e sorprendente. A suo tempo la notizia del coniglio fluorescente del bio-artista brasiliano Eduardo Kac, geneticamente modificato per emettere un debole bagliore verdastro quando si trovava al buio, grazie all’inserzione di un gene di medusa, fece il giro del mondo suscitando polemiche. In tanti si chiesero: è arte? Probabilmente sì. Ma per me ogni dubbio scompare di fronte al capolavoro presentato la settimana scorsa su Nature. Continua a leggere
I calcoli di Harvard scagionano CRISPR
 Faster, better, cheaper è un celebre slogan usato dalla Nasa, ma sembra pensato apposta per CRISPR. La tecnica di modificazione genetica più in voga nei laboratori, infatti, ha la fama di essere velocissima, a buon mercato e anche molto precisa. Questa reputazione, ampiamente meritata sul campo, era stata improvvisamente macchiata da uno studio pubblicato sul numero di giugno di Nature Methods, che ha messo in dubbio la precisione della tecnologia. Ma le notizie sulla morte di CRISPR erano fortemente esagerate, per dirla con Mark Twain. A poco più di un mese di distanza, l’archivio elettronico di pre-pubblicazione bioRxiv conta già tre analisi che smontano lo studio citato, e le critiche mosse sono così serie da aver spinto Nature Methods ad avvisare i propri lettori. In calce al lavoro è stata aggiunta una nota editoriale che suona come il preludio a una sconfessione ufficiale. Continua a leggere
Faster, better, cheaper è un celebre slogan usato dalla Nasa, ma sembra pensato apposta per CRISPR. La tecnica di modificazione genetica più in voga nei laboratori, infatti, ha la fama di essere velocissima, a buon mercato e anche molto precisa. Questa reputazione, ampiamente meritata sul campo, era stata improvvisamente macchiata da uno studio pubblicato sul numero di giugno di Nature Methods, che ha messo in dubbio la precisione della tecnologia. Ma le notizie sulla morte di CRISPR erano fortemente esagerate, per dirla con Mark Twain. A poco più di un mese di distanza, l’archivio elettronico di pre-pubblicazione bioRxiv conta già tre analisi che smontano lo studio citato, e le critiche mosse sono così serie da aver spinto Nature Methods ad avvisare i propri lettori. In calce al lavoro è stata aggiunta una nota editoriale che suona come il preludio a una sconfessione ufficiale. Continua a leggere
Il tablet veste CRISPR
Craig Venter fa il pieno di biodiesel con CRISPR

Si chiama Nannochloropsis gaditana e rappresenta la nostra migliore chance di vincere la scommessa dei biocarburanti. Questa micro-alga non ha bisogno di acqua dolce per vivere (se la cava bene in ambienti marini e salmastri) e produce una grande quantità di grassi che possono essere facilmente convertiti in biodiesel. Ma le doti naturali vanno coltivate. E questo è ciò che hanno fatto Imad Ajjawi e colleghi alla Synthetic Genomics, raddoppiando il contenuto lipidico di questo organismo con l’aiuto della tecnica di editing genetico CRISPR. Continua a leggere
Parlano di noi, a Superquark
(dalla puntata del 21 giugno 2017)
