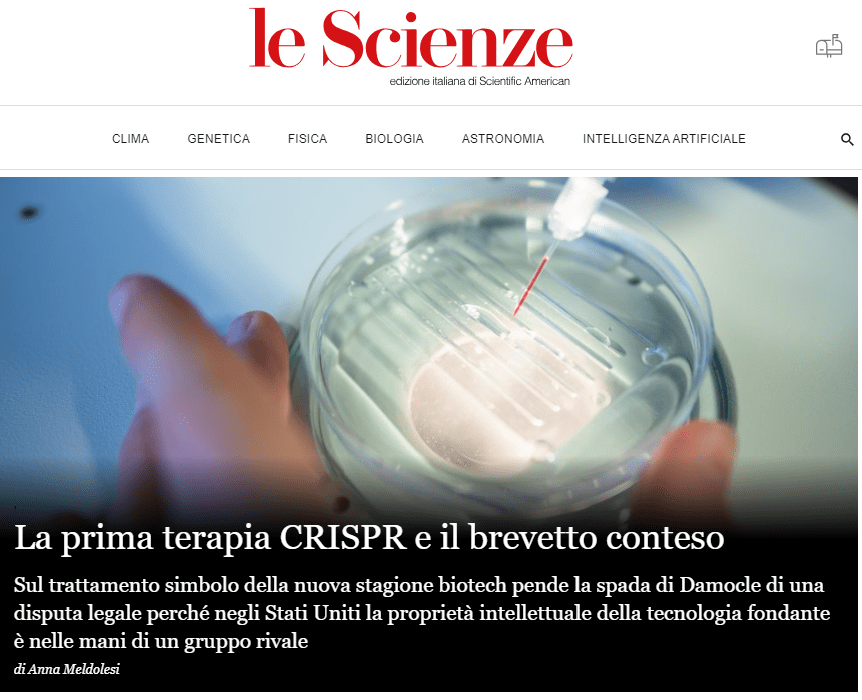
La recente approvazione del Casgevy rappresenta il primo successo ufficiale delle terapie basate sull’editing genetico. Il trattamento per anemia falciforme e talassemia è arrivato a tempo di record, appena 11 anni dopo l’invenzione di CRISPR. “Due malattie in meno. Ne restano cinquemila”, ha commentato Fyodor Urnov, che all’Innovative Genomics Institute (IGI) si occupa di tecnologia e traslazione. Ma fra tante patologie in attesa di una cura, quali saranno le prossime a beneficiare di CRISPR? A che ritmo possiamo aspettarci che arrivino i nuovi trattamenti? Per orientarsi tra annunci e pubblicazioni, coltivando le speranze senza cadere nel sensazionalismo, è utile il periodico aggiornamento curato dall’istituto californiano. Il bilancio è decisamente positivo, ma non manca qualche delusione. [Continua su Osservatorio Terapie Avanzate]