
Sin dalle sue origini Homo sapiens ha spinto molte specie sull’orlo dell’estinzione, e talvolta irrimediabilmente oltre. Lo abbiamo fatto per sfamarci, difenderci, colonizzare, coltivare, bonificare, arricchirci. Spesso senza esserne pienamente consapevoli. Farlo oggi, intenzionalmente, nell’epoca dei trattati sulla biodiversità e degli sforzi per la conservazione, può apparire come un atto assurdo ed estremo. Ma non mancano gli esempi di organismi considerati altamente nocivi per la salute o per l’ambiente. In quali circostanze sarebbe ammissibile eliminarli ricorrendo alle tecnologie genetiche? Abbiamo il diritto di cancellare dalla faccia della Terra un’altra forma di vita? Probabilmente queste domande non hanno una sola risposta giusta, ma un gruppo di biologi, ecologi, naturalisti, bioeticisti e scienziati sociali ha organizzato un workshop per discuterne e ha provato a rispondere sulla rivista Science analizzando tre casi concreti: la mosca assassina (Cochliomyia hominivorax) in Sud America, la zanzara della malaria (Anopheles gambiae) in Africa, i topi e i ratti (Mus musculus, Rattus rattus, Rattus norvegicus) nelle isole dell’Oceania. [Continua su Le Scienze]





 Scegliete una parola per completare la frase. “I gene drive sono un ambizioso esperimento di …”. Genetica? Ecologia? Evoluzione? Ovviamente i gene drive sono tutto questo e di più. A pensarci bene, rappresentano anche un grande esperimento di tipo sociale, su comunicazione del rischio, public engagement, processi partecipativi. Non sappiamo ancora se questi “
Scegliete una parola per completare la frase. “I gene drive sono un ambizioso esperimento di …”. Genetica? Ecologia? Evoluzione? Ovviamente i gene drive sono tutto questo e di più. A pensarci bene, rappresentano anche un grande esperimento di tipo sociale, su comunicazione del rischio, public engagement, processi partecipativi. Non sappiamo ancora se questi “

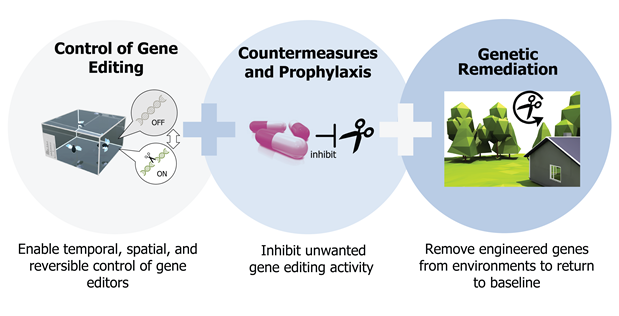
 Il vaccino tarda ad arrivare, le zanzariere non bastano, bonificare l’Africa sembra un’impresa impossibile. Ma per sconfiggere la malaria c’è una nuova speranza, che arriva direttamente dalla frontiera più avanzata della tecnologia per la modificazione genetica CRISPR. Lo stratagemma prevede una specie di reazione genetica a catena, che può essere utilizzata dai ricercatori per ridurre drammaticamente il numero delle zanzare responsabili della trasmissione del plasmodio, il parassita responsabile della malaria. A renderla possibile sono degli elementi che sono detti “drive genetici” o “gene drive” e funzionano come degli acceleratori per la diffusione dei geni di interesse. In questo caso geni dannosi per le zanzare della specie Anopheles gambiae e utili a noi. Normalmente, in accordo con le leggi di Mendel, un gene ha il 50% di probabilità di essere trasmesso da un genitore a un figlio, ma se viene guidato con un drive le sue chance sfiorano il 100%. È così che nel giro di qualche generazione un gene programmato per danneggiare una specie nociva può propagarsi con un effetto domino in tutta la popolazione, fino a farla collassare. Questo filone di ricerca avveniristico ha tra i suoi fondatori un medico italiano: Andrea Crisanti, dell’Imperial College London. Lo abbiamo intervistato per farci spiegare tempi e modi, punti di forza e rischi di questo approccio. Grazie al suo impegno il progetto internazionale “
Il vaccino tarda ad arrivare, le zanzariere non bastano, bonificare l’Africa sembra un’impresa impossibile. Ma per sconfiggere la malaria c’è una nuova speranza, che arriva direttamente dalla frontiera più avanzata della tecnologia per la modificazione genetica CRISPR. Lo stratagemma prevede una specie di reazione genetica a catena, che può essere utilizzata dai ricercatori per ridurre drammaticamente il numero delle zanzare responsabili della trasmissione del plasmodio, il parassita responsabile della malaria. A renderla possibile sono degli elementi che sono detti “drive genetici” o “gene drive” e funzionano come degli acceleratori per la diffusione dei geni di interesse. In questo caso geni dannosi per le zanzare della specie Anopheles gambiae e utili a noi. Normalmente, in accordo con le leggi di Mendel, un gene ha il 50% di probabilità di essere trasmesso da un genitore a un figlio, ma se viene guidato con un drive le sue chance sfiorano il 100%. È così che nel giro di qualche generazione un gene programmato per danneggiare una specie nociva può propagarsi con un effetto domino in tutta la popolazione, fino a farla collassare. Questo filone di ricerca avveniristico ha tra i suoi fondatori un medico italiano: Andrea Crisanti, dell’Imperial College London. Lo abbiamo intervistato per farci spiegare tempi e modi, punti di forza e rischi di questo approccio. Grazie al suo impegno il progetto internazionale “