A due anni dall’approvazione commerciale di Casgevy solo una sessantina di persone affette da anemia falciforme o talassemia hanno potuto beneficiarne, per via di un problema tecnico che la prossima generazione di trattamenti proverà a superare
Il via libera da parte dell’Europa è arrivato il 13 febbraio del 2024, qualche mese dopo l’ok di Gran Bretagna e Stati Uniti. Su Le Scienze avevamo festeggiato lo storico evento, tracciando l’identikit della prima terapia CRISPR approvata nel mondo: il Casgevy, noto anche come exa-cel. Avevamo anticipato che la complessità del trattamento, probabilmente, avrebbe rallentato la sua adozione, ma il quadro tracciato la scorsa settimana da un’inchiesta della testata medica STAT rappresenta comunque una delusione.
Mettendo insieme Europa, Usa e Medio Oriente, le persone trattate con il prodotto messo a punto da Vertex Pharmaceuticals insieme a CRISPR Therapeutics sono state poco più di sessanta. Un numero davvero basso, se si considera che in passato gli esperti hanno stimato che circa 32.000 cittadini americani ed europei potrebbero essere candidati al trattamento, 25.000 dei quali per l’anemia falciforme. A conti fatti, il Casgevy fatica persino a tenere il ritmo di adozione (anch’esso lento) della terapia genica convenzionale per anemia falciforme e talassemia (Lyfgenia di Genetix) che prevede l’inserzione di un gene extra anziché la correzione del DNA originario del paziente. Cosa è successo?
Per spiegarlo dobbiamo innanzitutto ricordare che parliamo di terapie “ex vivo”, cioè che prevedono il prelievo di cellule del paziente (quelle ematopoietiche), la loro modificazione genetica in laboratorio e la loro re-infusione, dopo aver eliminato la controparte difettosa all’interno del corpo (mieloablazione). Per paradosso è il primo passaggio, quello che sembrerebbe più di routine, che si è rivelato inaspettatamente difficile. Al punto che, per consentire la raccolta di un numero di cellule sufficiente per avviare il trattamento Casgevy, alcuni pazienti hanno dovuto affrontare fino a cinque ricoveri ospedalieri diversi, e una piccola percentuale di loro ha abbandonato il percorso.
Una volta eseguito, il trattamento dà ottimi risultati, perché libera i pazienti dalle dolorosissime crisi e da altre gravi complicanze, che contribuiscono ad accorciare di decenni le aspettative di vita. Ma l’intero processo, oltre a essere costoso (circa 2 milioni di dollari per paziente), ha una durata difficilmente prevedibile e talvolta molto lunga. Fra attese e ospedalizzazioni, può essere necessario oltre un anno.
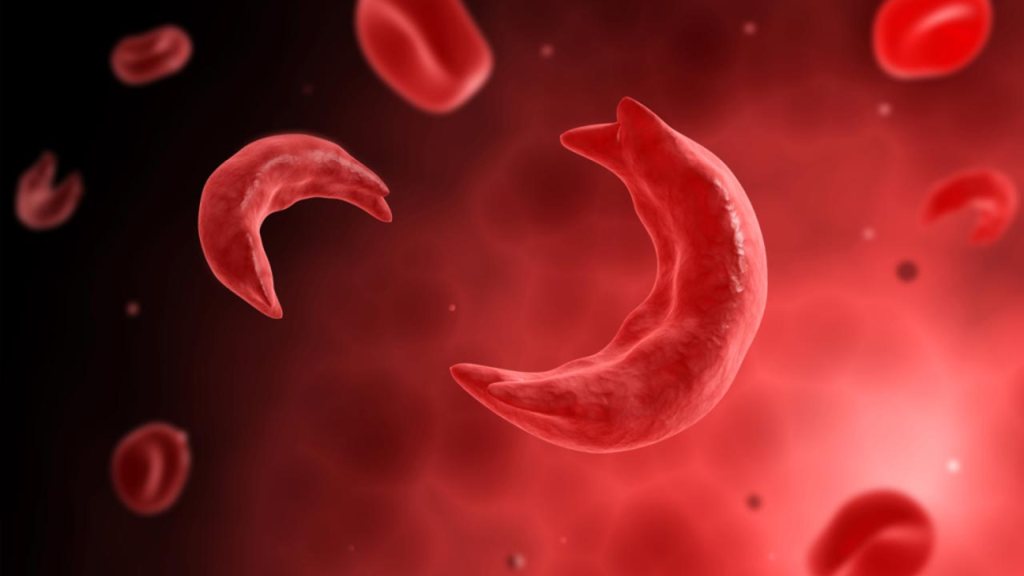
Il primo problema è che il prelievo avviene con procedure che funzionano bene per raccogliere le staminali dai pazienti che necessitano di trapianti cellulari per altre condizioni, ma non nei casi di anemia falciforme. Per “mobilizzare” le staminali dal midollo osseo fino al sangue i medici sono soliti impiegare due farmaci, ma solo uno di essi può essere utilizzato in sicurezza nei pazienti affetti da questa malattia, in cui i globuli rossi assumono la caratteristica forma a falce, arrivando a ostruire i vasi sanguigni. Le cellule, poi, devono essere raccolte con una macchina per “aferesi”, progettata per persone con normali globuli rossi. In pratica la centrifuga che separa i componenti del sangue crea bande diverse in presenza di cellule deformate.
Un altro ostacolo nasce dal fatto che, per confezionare il trattamento CRISPR, è necessario un numero più elevato di cellule staminali rispetto alla terapia genica classica. Il protocollo Casgevy, infatti, prevede che le forbici molecolari CRISPR entrino nelle cellule bersaglio rese permeabili da una scarica elettrica, invece di usare un virus-navetta come nella terapia genica convenzionale. Ebbene, questo procedimento chiamato elettroporazione può danneggiare una parte delle cellule, e anche il taglio della doppia elica può ucciderne altre, lasciandone poche intatte e geneticamente corrette.
Va detto che nel corso dei mesi le procedure di prelievo sono diventate più efficienti, ma secondo alcuni specialisti è probabile che nel prossimo futuro il Casgevy sarà soppiantato da trattamenti di editing più avanzati. Nel 2027 è atteso il via libera di una terapia concorrente sviluppata da Beam Therapeutics (BEAM-101 o risto-cel), che dovrebbe presentare un vantaggio. L’obiettivo è sempre sopperire ai difetti dell’emoglobina adulta riattivando la produzione di emoglobina fetale, ma mentre il primo protocollo lo raggiunge tagliando la doppia elica, il secondo ricorre a un approccio più delicato, con una correzione mirata del DNA che non passa per la recisione di entrambi i filamenti (editing di basi).
Il Casgevy, insomma, si è assicurato un posto nei libri di storia della medicina, in qualità di primo farmaco della classe CRISPR, ma probabilmente non passerà molto tempo prima che, negli ospedali, debba cedere il testimone alla tecnologia successiva, che in gergo giornalistico è già stata ribattezzata CRISPR 2.0.
